01. Oktober 2023: Decentralized Clinical Trials and the use of Digital Health Technologies
Wien, 01.10.2023 – Text: Catarina Carrão With the impact of the COVID-19 pandemic, Decentralized clinical trials (DCTs) and digital health technologies (DHTs) gained a momentum in medical research, allowing for clinical study participants to remotely partake in trials using state-of-the-art DHTs.1-3 What are Decentralized Clinical Trials? According to Dr. Leonard Sacks, associate director for clinical […]
21. August 2023: Pragmatic Clinical Trials

Wien, 21.08.2023 – Text: Catarina Carrão Schwartz and Lellouch pragmatic views The Merriam-Webster dictionary defines Pragmatism has a practical approach to problems and affairs.1 In relation to clinical trials, pragmatism surfaced in 1967 with an article from Schwartz & Lellouch, due to concerns that many trials did not adequately inform practice because they were optimized to determine efficacy.2 At the time, authors […]
10. Juli 2023: “Opt-In or Opt-out” The new European Health Data Space

Wien, 10.07.2023 – Text: Catarina Carrão “Opt-In or Opt-out” The new European Health Data Space One year ago, the European Commission proposed a new European Health Data Space (EHDS) legislative proposal to unleash a revolution in health data sharing and set-up a framework for data reuse, while ensuring the protection of this highly sensitive data. The objective is […]
Alzheimer wird behandelbar

Von Ghazaleh Gouya-Lechner, Joana Enes & Maria Teresa Ferretti Verröffentlicht am Mittwoch, 28 Juni 2023 in der Wiener Zeitung. Die Alzheimer-Krankheit erlebt heute, was die Multiple Sklerose mit den Interferonen erlebt hat: das Aufkommen von Medikamenten, die die Krankheit für Millionen von Patienten behandelbar machen. So befinden sich Substanzen im Anmarsch, die das Beta-Amyloid, das die bekannten Plaques […]
Medikamentenentwicklung : Der Avatar als Versuchsperson
Künftig könnten digitale Zwillinge klinische Studien absolvieren. Schon heute werden Medikamente mit KI entwickelt. Denken wir an Avatare, stellen sich die meisten jene großen, blauen digitalen Wesen mit anthropomorphem Aussehen aus dem gleichnamigen Science-Fiction-Epos vor. Oder jene künstlichen Figuren, die uns in der virtuellen Welt agieren lassen. Künftig könnten Avatare als digitale Zwillinge unseres Selbst […]
14. Juni 2023: Diversity in Clinical Trial Populations

Wien, 14.06.2023 – Text: Catarina Carrão Historically, there has been an underrepresentation of people from diverse groups in clinical trials, which has created gaps in the understanding of treatment safety and effectiveness across different populations. For example, certain demographic characteristics such as sex, age, race, and ethnicity, can have an impact on how a person […]
17. Mai 2023: Patient Engagement in Clinical Trials

Wien, 17.05.2023 – Text: Catarina Carrão The patient’s voice is essential in the different regulatory activities throughout a medical product’s lifecycle. An individual’s real-life experience as a patient living with a condition offers a crucial complementary perspective to understand the value of the scientific evidence necessary for the evaluation and management of medical products. The […]
17. April 2023: Monitoring of Clinical Investigations: A Risk-Based Approach

Wien, 17.04.2023 – Text: Catarina Carrão The U.S. Food and Drug Administration (FDA) has just released an extension to the guidance “A Risk-Based Approach to Monitoring of Clinical Investigations”, previously published in 2013. The new guidelines are intended for clinical investigations regarding human drug and biological products, medical devices, and combination products; and it offers recommendations […]
Medikamentenkrise wird nicht weggehen
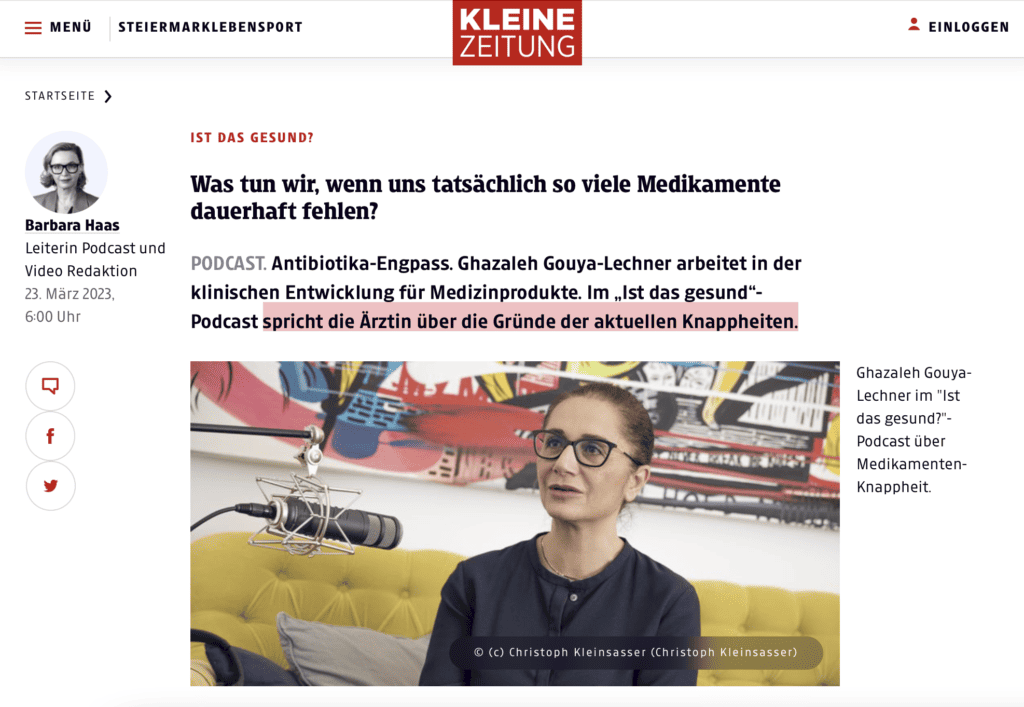
von Barbara Haas – Leiterin Podcast und Video Redaktion 23. März 2023, 6:00 Uhr PODCAST. Antibiotika-Engpass. Ghazaleh Gouya-Lechner arbeitet in der klinischen Entwicklung für Medizinprodukte. Im „Ist das gesund“-Podcast spricht die Ärztin über die Gründe der aktuellen Knappheiten. Das Kind ist krank, doch es gibt kein Antibiotikum. Und auch keine Aussicht auf schnelle Lieferung. Mit diesem Faktum […]
22. March 2023: Mut ist die beste Medizin

Wien, 22.03.2023 – Text: Susanne Mayer Arzneimittel und Medizinprodukte herzustellen und zur Zulassung zu bringen, braucht viel Zeit und noch mehr Know-how. Die Medizinerin und klinische Forschungsexpertin Ghazaleh Gouya begleitet Start-ups aus dem Medtech- und Biotech-Bereich vom Anfang bis zur Marktreife, um nicht an den regulatorischen Hürden zu scheitern. 13 Jahre: So lange dauert es […]

